Guillermo Montoya, director de investigación: El científico español que innova en CRISPR desde Dinamarca
Este biólogo y su equipo trabajan para desvelar la estructura de las distintas tijeras moleculares y así afinar la edición genética. Es también cofundador de TwelveBIO, una spin off de la Universidad de Copenhague, creada con el objetivo de mejorar el diagnóstico y el tratamiento con herramientas CRISPR, que acaba de ser adquirida por una empresa estadounidense.

Guillermo Montoya (Madrid, 1967) dirige a un equipo de 20 investigadores en la Novo Nordisk Foundation Center for Protein Research (NNF-CPR), en la Universidad de Copenhague (Dinamarca). En este centro, el biólogo molecular ha destacado, entre otros, por sus estudios de la estructura y funcionamiento de diversas herramientas de edición genética CRISPR, cuyos resultados se han publicado en revistas como Nature y Cell.
Montoya, nacido en Madrid pero criado en Getxo (País Vasco), se mudó junto a su mujer y dos hijos a Copenhague en 2014, tras una oferta del NNF-CPR que “era difícil de rechazar”, según cuenta a SINC. “Me ofrecieron la oportunidad de trasladar mi grupo y organizar y dirigir el programa de estructura y función de proteínas”, comenta.
Previamente, estuvo cerca de una década en el Centro Nacional de Investigaciones Oncológicas (CNIO) como jefe del Grupo de Cristalografía de Macromoléculas. “Tenía ganas de un cambio y la situación de la ciencia en España, con continuos recortes, me animó aún más”.
Financiación y motivación
Señala que la decisión no estuvo motivada únicamente por el aspecto económico. “La financiación es muy importante en ciencia, pero la motivación, el ambiente de trabajo con tus compañeros y el apoyo por parte del centro son fundamentales. Estos factores, que no se valoran lo suficiente en muchos sitios, aquí son considerados esenciales antes de incorporar a una persona a un grupo de investigación”, subraya.
Su equipo está compuesto por investigadores e investigadoras de nueve nacionalidades diferentes y que vienen de los ámbitos de bioquímica, biofísica, criomicroscopía, biología molecular, computación y biología celular.
En el ámbito de la edición con las diferentes herramientas corta-pega genético CRISPR, “hemos intentado aportar nuestro granito de arena desde el punto de vista más estructural”, apunta.
Según comenta, su grupo en el CNIO, en Madrid, llevaba trabajando en el diseño de nucleasas para editado genético desde 2003. “En 2008 publicamos en Nature un estudio que describía la corrección de una de las mutaciones que generan xeroderma pigmentosa —una enfermedad rara que causa una extrema sensibilidad a los rayos ultravioleta y un riesgo alto de cáncer— utilizando meganucleasas. El problema de ese sistema era que rediseñar las meganucleasas para que reconociesen nuevas secuencias de ADN era difícil y muy costoso”.
Cas9 entra en escena
La revolución a este campo llegó en 2012 con el descubrimiento por parte de Jennifer Doudna y Emmanuelle Charpentier del bisturí molecular CRISPR Cas9, que permite editar de manera sencilla y barata el ADN de cualquier organismo, y con el que estas científicas lograron el Premio Nobel de Medicina en 2020.
Esta herramienta no se hubiera podido desarrollar sin la contribución del biólogo español Francisco Mojica, descubridor de las secuencias CRISPR, un mecanismo de defensa incorporado en el ADN de los microorganismos para enfrentarse a los virus. “La investigación pionera de Mojica fue la que abrió el camino para el desarrollo de CRISPR Cas9, reconocía la propia Doudna en una entrevista con SINC.
Cas9 ya se ha aplicado en el tratamiento de ciertos tipos de cáncer, enfermedades de retina, anemia de células falciformes y beta talasemia. También en cultivos y en ganadería y en otros usos menos éticos, como fue la creación de bebés modificados por el genetista chino He Jianku, que causó un gran escándalo y acabó con este científico en la cárcel.
Según Montoya, cuando su grupo del NNF-CPR empezó a trabajar con CRISPR, “la mayoría de los trabajos se centraban en Cas9, tras los artículos ya clásicos de Doudna y Charpentier o de su rival Feng Zhang”.
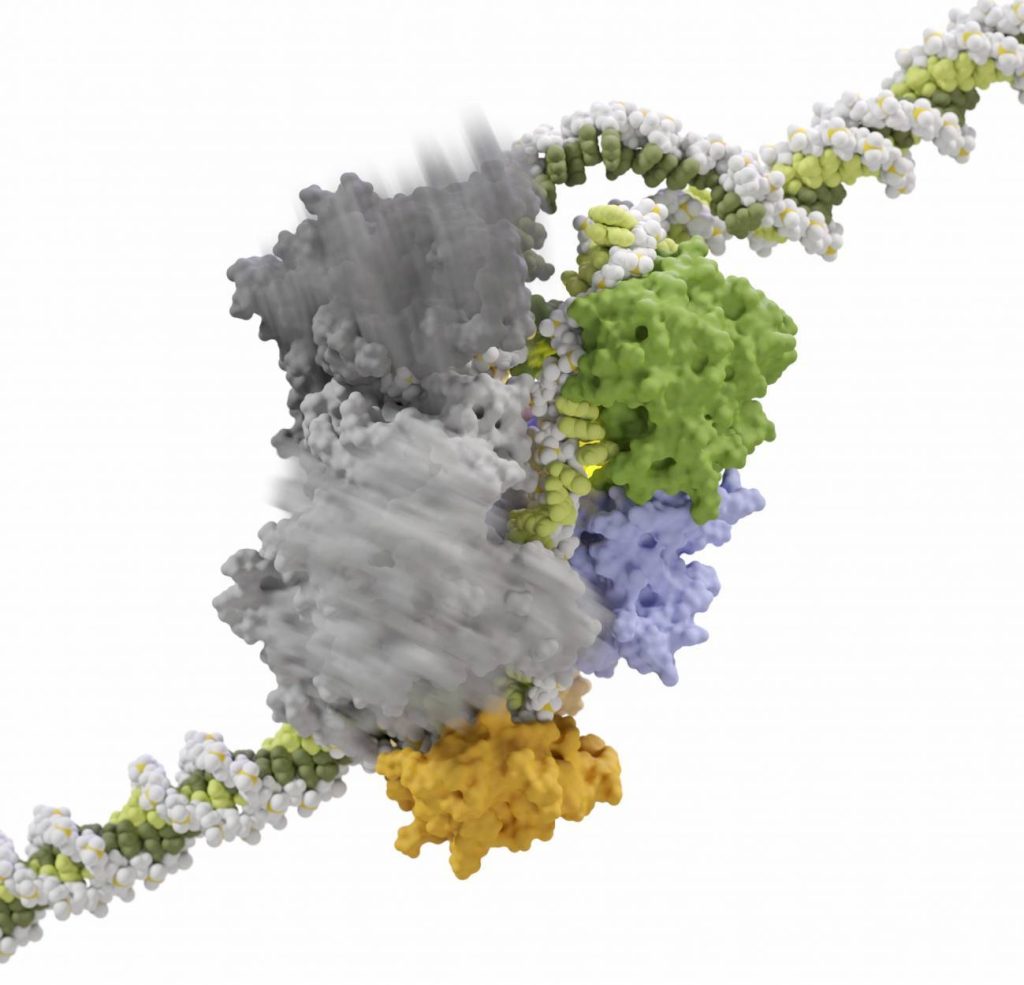
Más tijeras genéticas en la caja de herramientas
Sin embargo, añade, “unos años más tarde el grupo de Zhang en el Broad Institute caracterizó bioquímicamente una nueva endonucleasa guiada por ARN que llamó Cpf1, y que más tarde se rebautizó como Cas12a”.
“Mi grupo contribuyó con un estudio a entender cómo funciona este bisturí molecular. La Cpf1 o Cas12a desenrolla y corta el ADN y actúa como un GPS para encontrar su destino dentro del intrincado mapa del genoma”, explica.
En este trabajo, publicado en Nature y en Cell, el equipo irradió la proteína cristalizada Cpf1 con rayos X para poder observar su estructura a resolución atómica y, posteriormente, utilizó criomicroscopía para entender como cortaba el ADN. Así, “pudimos ver como cambiaba de forma durante el proceso”, señala Montoya.
En la investigación “demostramos que se podía rediseñar esa enzima. Las propiedades de estas variantes las hacen muy atractivas para poder ser aplicadas en biomedicina”.
“Hemos visto que Cas12a produce menos efectos indeseados como herramienta de corta-pega genético, que Cas9. Esto se debe a que genera extremos cohesivos —mientras que Cas9 produce extremos romos—. De esta manera, favorece la inserción de fragmentos nuevos de ADN. Por ello, esperamos que este bisturí se convierta en la principal herramienta molecular de edición genética”, resalta el investigador.
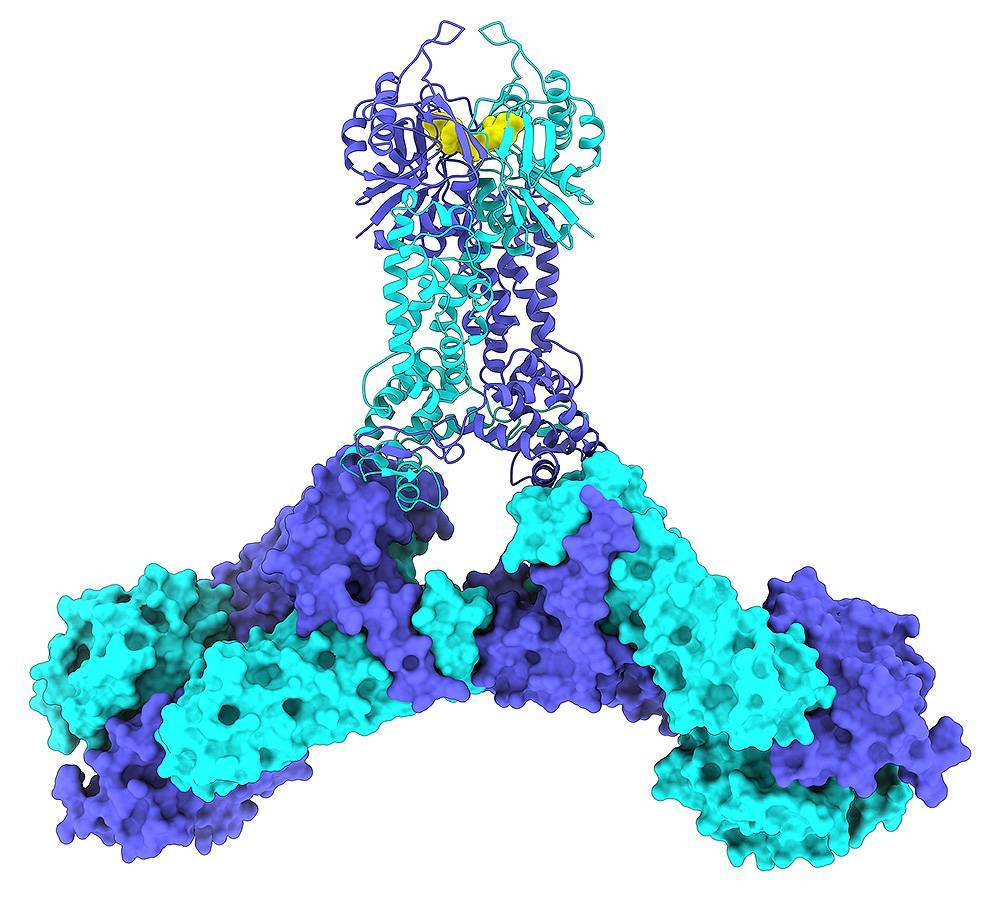
El interruptor de las defensas CRISPR en bacterias
En otro de los trabajos, el grupo logró mapear los mecanismos que usan las células bacterianas para defenderse de ataques de virus u otras bacterias con CRISPR. Para lograrlo, Montoya y sus colegas emplearon un criomicroscopio electrónico de última generación y fuentes de radiación sincrotrón. Los resultados se publicaron en Nature Communications.
En esta investigación, también describieron la forma en la que estas defensas pueden ser activadas en el momento preciso, como si de un interruptor se tratara. En concreto, mostraron cómo una célula bacteriana atacada por un virus activa una molécula llamada COA (oligoadenilato cíclico), que, a su vez, activa un complejo de proteínas CRISPR Cas, denominado CSX1, para erradicar al atacante.
“Logramos ver el momento exacto en el que CSX1 comienza a trocear al invasor con las tijeras moleculares. Además, fuimos capaces de activar este proceso biológico de forma exitosa”, indica.
El científico opina que complejos CRISPR como CSX1, “que son menos populares que Cas9 o Cas12a, son tremendamente interesantes por la función inmunitaria que llevan a cabo y por cómo la realizan”. Por ello, agrega, un mayor conocimiento de estos sistemas podría hacer posible el desarrollo de nuevas aplicaciones en biomedicina y biotecnología.
Una empresa para el diagnóstico y el tratamiento
Precisamente en torno a las tijeras moleculares Cas12a, Montoya y Stefano Stella, uno de los investigadores de su equipo, crearon en 2019 una empresa llamada TwelveBIO, con el objetivo de mejorar la tecnología CRISPR aplicada al diagnóstico y tratamiento de enfermedades.
La compañía se fundó como una spin off de la Universidad de Copenhague y recibió subvenciones de fundaciones danesas de cerca de 500.000 euros para su puesta en marcha.
Montoya comenta que Cas12a es una herramienta de edición genética de nueva generación muy útil, gracias a su mayor especificidad en comparación con la proteína Cas9. La compañía se ha centrado este tiempo en las posibles aplicaciones de este bisturí molecular. “Tiene un gran potencial para la identificación de biomarcadores, como patógenos y mutaciones de cáncer en muestras de pacientes clínicos”, señala.
TwelveBIO acaba de ser adquirida por Ensoma, una empresa de medicamentos genómicos con sede en Boston (EE UU). El cierre de la operación se ha producido después de la reciente autorización de la Autoridad Empresarial Danesa, de conformidad con su legislación sobre inversiones extranjeras directas.
Tras el acuerdo de venta, el cofundador Stefano Stella se ha incorporado a Ensoma como vicepresidente de edición genética, en tanto que Montoya formará parte del consejo asesor científico de la compañía estadounidense.
Montoya considera que la experiencia de Twelve Bio “es un ejemplo de que la diferencia que algunos establecen entre ciencia básica y aplicada es ficticia”.
Esta experiencia, destaca, “muestra que desde una aproximación básica que conduce a la obtención de conocimientos fundamentales, estos pueden ser trasladados a aplicaciones prácticas con interés económico”.

Un futuro prometedor
“La edición genética con CRISPR es ya una realidad, está siendo aplicada para tratar enfermedades, por ejemplo, en la generación de células CAR-T”, apunta el investigador español. “En este momento el campo está explotando, los resultados de los primeros ensayos clínicos para diferentes patologías realizados por varias empresas son positivos, y están resultando muy esperanzadores”.
Montoya se muestra convencido de que más aplicaciones, y no solo en biomedicina, están en camino. “El volumen de negocio abarca un área tan amplia que es difícil de calcular. Quizás uno de los principales problemas que debemos tener en cuenta en aplicaciones médicas, es cómo vamos a mejorar todos los procesos que son necesarios para tratar una de estas enfermedades utilizando edición genética para poder hacer sus costes accesibles a los pacientes y los sistemas de salud”, concluye.
Fuente: SINC


